
|
코로나19 백신에 대한 전망 | |||
| 코로나19로 인해 전 세계가 패닉에 빠졌다. 경제는 침체되고 회복 기미는... |


  |
 |  |
코로나19로 인해 전 세계가 패닉에 빠졌다. 경제는 침체되고 회복 기미는 아직까지 요원하다. 백신 개발이 시급한 이유가 여기에 있다. 그렇다면 현재 코로나19 백신 개발은 어디까지 진행이 되었을까?

코로나19(COVID19)를 일으키는 코로나 바이러스에 대응하는 백신 개발 및 제공에 빠른 진전이 이루어지고 있다. 생명공학 기업 이노비오 파마수티컬스(Inovio Pharmaceuticals)의 연구진은 바이러스에 대한 염기서열을 받으면 단 3시간 만에 백신을 설계할 수 있는 능력이 있다. 이노비오는 펜실베이니아 대학교(University of Pennsylvania)와 위스타 연구소(Wistar Institute)의 과학자들로 구성된 팀과 함께 지난 1월부터 백신을 연구해오고 있다. 그리고 83일 만에, 최초로 인간을 대상으로 임상을 시작했다. 이는 백신 개발 역사에서 전례가 없을 정도의 속도이다.
이미 완료된 연구는 백신이 ‘테스트 튜브에서’ 작용하고 있음을 보여주고 있다. 이 연구의 다음 단계는 인간이 백신에 잘 견디도록 저위험군을 대상으로 테스트하는 것이다. 캔사스 시티와 펜실베이니아 대학교의 몇몇 장소에서 소위 임상 1상(Phase-One Clinical Trial) 기간, 약 40명이 테스트를 받고 있다. 이 테스트의 최종 결과는 이번 여름에 나올 것으로 예상된다.
환자 내성과 연관된 문제가 발생하지 않으면, 이노비오는 임상 2상을 진행하는 데, 이 실험에서는 ‘위험군(at-risk population)’을 테스트할 것이다. 임상 2상에서는 더 많은 수의 환자를 테스트하여 인간에 대한 백신 효능을 확인하게 된다. 임상 2상을 준비하면서, 이노비오는 이미 수천 명의 피험자들에게 충분한 투약량을 생산했다.
기업들이 빛의 속도로 움직여줄 것을 요구받는 일은 이번이 최초가 아니다. 이노비오는 독점적인 DNA 서열 디지털 매핑을 사용하여 단 7개월 만에 지카(Zika) 바이러스 백신을 출시할 수 있었다. 그러나 코로나 백신을 출시하는 데는 시간이 더 오래 걸릴 수 있다. 이노비오는 최근 백신을 시장에 출시하는 과정을 가속화할 목적으로 미국 전염병대비혁신연합(Coalition for Epidemic Preparedness Innovations)으로부터 900만 달러의 보조금을 받았다.
그런데 대중의 기대와 달리 코로나19 백신은 왜 지연되고 있을까? 임상 3상으로 불리는 ‘확대 효능 연구’에 일반적으로 매우 오랜 시간이 걸리기 때문이다. 이것이 백신 개발에 일반적으로 수 년에서 수 십 년이 걸리는 이유이다. 또한 정상 경로를 따른 승인받은 백신도 이를 상용화하는 데, 대략 1년 반에서 2년 정도가 소요된다. 이는 미 질병통제예방센터(CDC, Centers for Disease Control and Prevention)와 기타 유관 기관들이 말하는 것이다.
그러나 위스타 연구소의 데이비드 와이너(David Wiener) 박사가 지적했듯, 이것이 에볼라의 경우와 마찬가지로 코로나 바이러스 백신이 빠르게 등장하지 않을 것이라는 의미는 아니다. 와이너 박사에 따르면, 서아프리카에서 에볼라 백신이 임상 1상 테스트가 된 후, 연구진은 예외적으로 상당히 효과적인 임상 디자인을 구축한 바 있다. 이 임상 디자인은 연구진이 매우 적은 수의 사람들만 활용하여 매우 빠르게 임상 2상을 진행할 수 있게 해줬다. 마찬가지로 와이너 박사는 노인과 같은 고위험군이 백신을 훨씬 더 빠르게 받을 수 있고, 필요한 경우 ‘긴습사용승인(EUA: Emergency Use Authorization)’을 진행할 수 있다고 믿고 있다.
‘긴급사용승인’은 연구자들이 초기 연구를 마친 후, 그 치료가 안전하면 보다 광범위하게 그것을 배포할 수 있도록 승인을 얻는 것이다. 이러한 접근 방식은 일반적으로는 사용되지 않는다. 그러나 옥스포드 대학교(Oxford University) 연구진을 통한 코로나19 백신의 긴급사용에 대한 수많은 논의가 있었고, 이들은 이 백신 실험을 여름 즈음에 시작할 예정이다.
중요한 것은, 이노비오의 백신 후보가 상용화에 도달하지 못하더라도 현재 백신 개발 파이프라인에 있는 수십 개의 다른 후보 백신 중 하나 이상에서 성공 가능성이 있다는 점이다. 미국 전염병대비혁신연합은 코로나19 백신 개발을 지원하기 위해 세계 보건 당국들, 백신 개발사들과 적극적으로 협력하고 있다. 이러한 시도를 더욱 촉진하기 위해, 이들은 공개적으로 이용 가능한 독점 소스로부터 확인된 백신 개발 프로그램들의 랜드스케이프(landscape) 데이터베이스를 지속적으로 유지하고 있다.
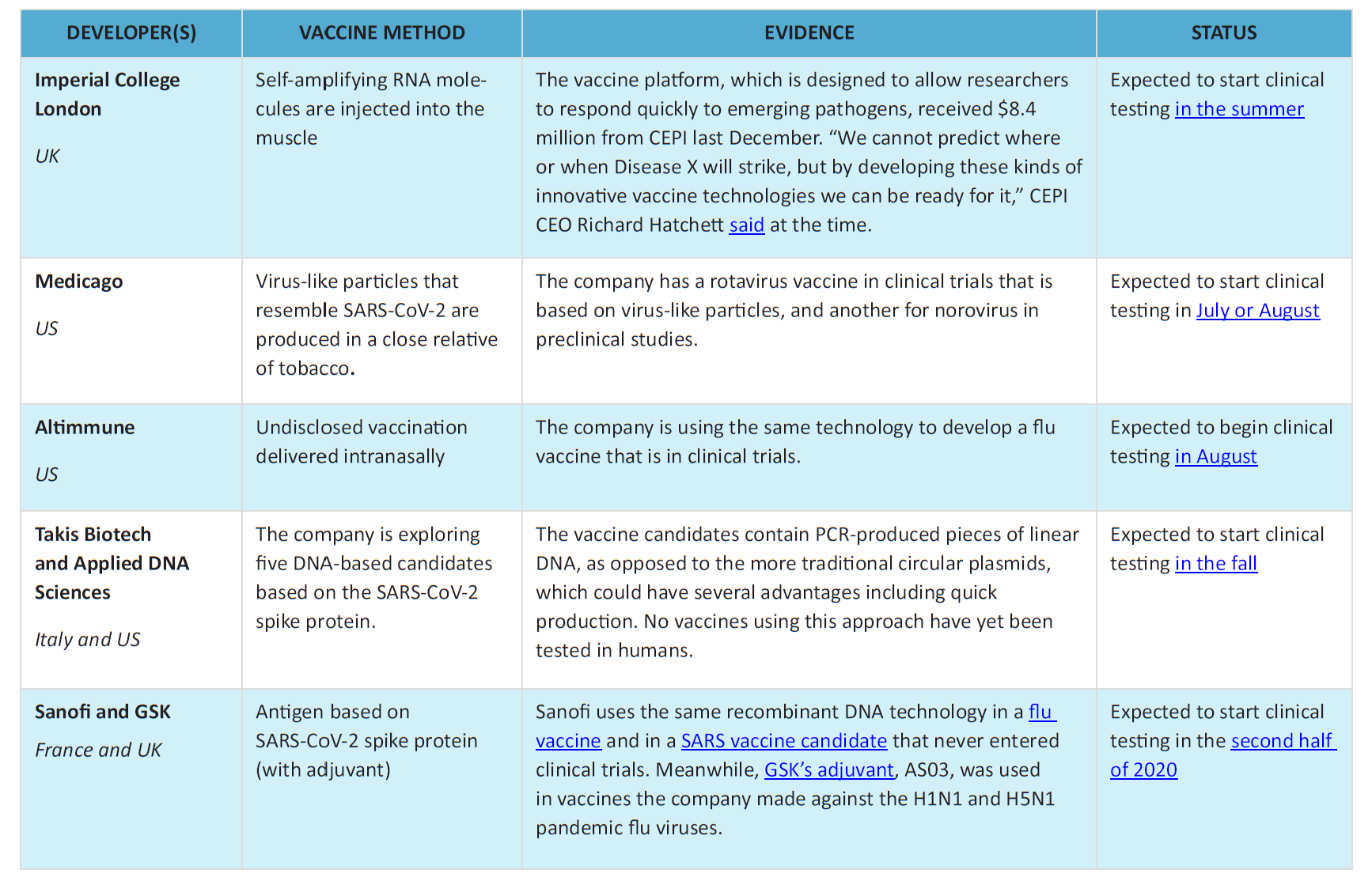
2020년 4월 8일 기준, 전 세계 코로나19 백신 R&D 랜드스케이프 데이터베이스에는 115 개의 백신 후보가 있고, 이들 중 78개는 활성 프로젝트로 확인되었다. 78개로 확인된 활성 프로젝트 중 73개는 아직까지 탐구 영역 혹은 임상 이전 단계에 있다. 반면 가장 진전을 이룬 후보 백신은 최근 임상 단계로 이동했다. 이러한 임상 후보에는 모더나(Moderna)의 mRNA-1273, 캔시노 바이오로직스(CanSino Biologicals)의 Ad5-nCoV, 이노비오의 INO-4800 및 LV-SMENP-DC뿐만 아니라 중국 선전 제노 면역의학연구소(Shenzhen Geno-Immune Medical Institute)의 병원체 특정 aAPC가 포함되어 있다. 또 다른 많은 백신 개발사들도 이미 2020년 내에 인간을 대상으로 하는 테스트를 시작할 계획을 발표했다.
.png)
코로나19 백신 자원과 관련하여 미국 정부 또한 적극적으로 도움에 나서고 있다. 미국은 4월 초, 존슨앤존슨(Johnson&Johnson), 모더나와 공동으로 코로나19 백신의 임상 테스트와 생산 인프라 개발을 동시에 지원한다고 발표했다. 3월 30일 존슨앤존슨은 10억 개 이상의 백신 도즈(dose, 1회 접종분)를 생산할 수 있는 능력을 갖추기 위해 미국 정부와 함께 10억 달러의 공동 투자를 발표했다. 미국 정부는 약 4억4천만 달러를 지원할 예정이다. 발표에 따르면, 이 자금은 비임상 연구들과 존슨앤존슨의 제약 자회사 얀센(Janssen)이 개발한 코로나19 시험용 백신 Ad26 SARS-CoV-2의 임상 1상 시험에 지원될 것이다. 「사이언스」지에 따르면 이 백신은 2019년 11월 콩고 민주 공화국에서 출시된 얀센의 연구용 에볼라 백신과 동일한 기술을 사용한다. 이 백신에 대한 임상 1상 시험은 올 가을부터 시작될 예정으로, 2021년 초 미국에서 ‘긴급사용승인’ 백신 생산을 목표로 하고 있다.
정부는 또한 SARS-CoV-2 mRNA-1273으로 불리는 코로나19 백신의 2상, 3상 임상 실험시험에서 모더나를 지원하는 데 노력을 기울이고 있다. 미 국립 알러지&감염병 연구소 (National Institute of Allergy and Infectious Diseases)와 협력하여 개발된 이 백신에 대한 1상 연구는 4월 초에 진행되었다.
2020년 4월 28일, 화이자(Pfizer Inc.)는 가을까지 긴급사용승인용 백신을 준비할 수 있다고 밝혔다. 화이자의 CEO 앨버트 불라(Albert Bourla)는 「월스트리트 저널(Wall Street Journal)」에 회사가 연말까지 수백만 도즈(dose, 1회 접종분)를 포함하는 광범위한 출시를 준비할 수 있다고 말했다.
미국 보건복지부의 생물의약품첨단연구개발국(BARDA)은 5개 또는 6개의 백신 후보를 지원할 계획이며 그 중 2개 또는 3개가 성공 가능성이 있다. 목표는 미국을 비롯한 전 세계를 위해 충분한 백신을 가능한 최대한 빠르게 제조하는 것이다.
이러한 진전과 과정을 통해 우리는 코로나19에 대해 다음과 같이 예측을 내려본다.
첫째, 미국과 영국이 ‘긴급사용승인’을 통해 2020년 후반에 일반인에게 백신을 제공할 수 있다.
이는 트럼프 대통령이 취임 첫 해에 옹호했던 ‘법안을 시행할 권리’와 일치하는 것이다. 그리고 트럼프와 영국 총리 보리스 존슨은 둘 다 ‘어떤 기대’를 관리하는 것이 중요하다는 것을 알고 있기 때문에, 약속은 가급적 적게 하고 성과를 기대 이상으로 전달하기를 원한다. 따라서 임상 1상 실험에서 독성이나 심각한 부작용이 없으면, 고위험군에게 효과적인 것으로 보이는 백신을 배포하는 데 무리가 없을 것이다. 이러한 조치는 경제 활동과 여론에 막대한 영향을 미칠 것이다.
둘째, 2021년에 전 세계적으로 수십억 도즈의 백신이 누구의 주도로 출시되는가에 따라 미국과 중국에 대한 세계의 인식에는 큰 변화가 발생할 것이다.
현재 진행 중인 그리고 앞으로 예측되는 미중 갈등의 시대에 국제적 인식은 군사력 이상의 것을 의미한다. 중국에서 발원된 이번 세계적 위기에 대한 해결책을 제공한다면 미국은 ‘미국 우선’ 정책으로 인해 상당히 손실된 동맹국들의 신뢰를 회복할 수 있을 것이다. 중국이 적절한 시기에 효과적인 백신을 개발하고 생산할 수 있다면 중국도 비슷한 결과를 얻을 수 있다.
셋째, 코로나19 백신 개발에 대한 놀라울 정도의 속도에서 우리가 학습한 것은 이러한 대응으로 인해 앞으로 미래의 전염병 대유행에 대한 대응력이 높아질 것이란 점이다. 즉, 미래의 전염병은 이러한 조치로 인해 덜 파괴적인 것이 될 가능성이 있다.
코로나19 바이러스에 대한 전 세계적인 백신 연구 개발 노력은 규모와 속도 면에서 전례가 없는 일이다. 특히, 속도에 대한 필요성을 감안할 때, 백신은 2021년 초까지 ‘간급사용승인 프로토콜’에 따라 일반인에게 제공될 수 있고 고위험군에게는 훨씬 더 빠르게 제공될 수 있다. 이는 전통적인 백신 개발 경로에서 비약적으로 발전한 것이다. 백신 개발에는 평균 10년이 넘는 시간이 소요된다. 최초의 에볼라 백신 개발에 있어서도 규모와 속도는 대단했는데, 에볼라 바이러스에 대한 대응에도 5년이 소요되었다. 그런데 현재 코로나19에 대한 대응은 이보다 훨씬 더 빠르게 진행되고 있다. 물론 이 규모와 속도가 성과를 내려면 새로운 백신 개발 패러다임을 활용하는 것이 필요하다. 병행 및 적용 개발 단계, 혁신적인 규제 프로세스, 확대 가능한 제조 능력 등이 이에 포함된다. 백신의 효능을 평가하기 위해, 코로나19에 특화된 동물 모델들도 개발되고 있다. ACE2 형질 전환 쥐, 햄스터, 족제비, 비인간 영장류등이 이에 포함된다.
넷째, 독감 백신과 마찬가지로 코로나19 백신도 돌연변이를 일으키는 모든 새로운 유형에 대해 100% 효과적이진 않겠지만, 다른 백신보다 더 필요한 백신이 될 것이다.
모든 것을 고려할 때, 현재 나타나고 있는 증거들의 추세는 코로나19 바이러스가 일반적인 인플루엔자 바이러스보다 더 치명적이지는 않다는 것이다. 이러한 증거는 계속 나타날 것 같다. 그러나 이 바이러스는 전염성이 월등하게 높다. 즉, 백신이 없으면 더 많은 사람들이 감염되고 그만큼 더 많은 사람들이 사망할 수 있다. 즉, 백신이 반드시 필요하다. 코로나19 바이러스에 대한 처치법, 백신의 부족과 결합된 이 바이러스에 대한 오해로 인해 사람들에게 더 큰 공황이 일어났다. 이는 뉴욕 이외 지역에서의 반응을 통해 알 수 있다. 다행히도 실행 가능한 치료법, 고위험군의 격리 및 상대적으로 효과적인 백신의 광범위한 이용 가능성으로 인해 2020년에 공황 상태에서 이제 벗어날 가능성이 커지고 있고, 앞으로는 지난 50년 동안 다른 인플루엔자 바이러스처럼 코로나19에 접근할 수 있는 길이 열릴 것이다.
.png)
.png)
* *
References List :
1. The Scientist. April 1, 2020. Amy Schleunes. US Selects Two COVID-19 Vaccine Candidates for Huge Investments.
https://www.the-scientist.com/news-opinion/us-selects-two-covid-19-vaccine-candidates-for-huge-investments-67367
2. The Scientist. April 1, 2020. Jef Akst. COVID-19 Vaccine Frontrunners.
https://www.the-scientist.com/news-opinion/covid-19-vaccine-frontrunners-67382
3. com. April 16, 2020. Nicolletta Lanese. When will a COVID-19 vaccine be ready?
https://www.livescience.com/coronavirus-covid-19-vaccine-timeline.html
4. Medical News Today. April 17, 2020. Ana Sandoiu. COVID-19: Vaccine may be ready by fall and other reasons for hope.
https://www.medicalnewstoday.com/articles/covid-19-vaccine-may-be-ready-by-fall-and-other-reasons-for-hope
5. April 9, 2020. Tung Thanh Le, Zacharias Andreadakis, Arun Kumar, Raul Gomez Roman, Stig Tollefsen, Melanie Saville & Stephen Mayhew. The COVID-19 vaccine development landscape.
https://www.nature.com/articles/d41573-020-00073-5
6. com. April 22, 2020. Perry Chiaramonte & Angela Bertorelli. Possible coronavirus vaccine enters human testing trial.
https://www.foxnews.com/health/possible-coronavirus-vaccine-human-testing-trial
 |  |
 |
The Promise of a COVID19 Vaccine
Rapid progress is being made toward delivering a viable vaccine for the coronavirus responsible for COVID19. For example, researchers at Inovio Pharmaceuticals were able to design a vaccine in just three hours once they received a sequence for the virus. Along with a team of scientists from the University of Pennsylvania and the Wistar Institute, Inovio has been working on that vaccine since this past January. And after just 83 days, they began the first human trial, which represents an absolutely unprecedented level of speed.
The research already completed proves that the vaccine works “in a test tube.” The new phase of the study involves testing the vaccine in low-risk people just to make sure the vaccine is well-tolerated by humans. Approximately 40 people are being tested during the so-called Phase-One Clinical Trial at locations in Kansas City and at the University of Pennsylvania. The final results from this test are expected this summer.

If no problems with patient tolerance emerge, Inovio will proceed with a Phase-Two Clinical Trial, in which the “at-risk population” will be tested. Phase-two is where they test it on larger numbers of patients and confirm the vaccine’s efficacy in humans. In preparation for Phase-Two, Inovio has already produced enough dosing for several thousand test subjects.
This is not the first time the firm has been asked to move at lightning speed. Using proprietary digital mapping of DNA sequences, Inovio was able to get a Zika virus vaccine to market in just seven months. However, getting a corona vaccine to market may take longer. Inovio recently received a $9 million grant from the Coalition for Epidemic Preparedness Innovations for the express purpose of speeding up the process of getting its vaccine to market.
Why the delay? “Expanded efficacy studies,” which are called Phase-three Clinical Trials, normally take a very, very long time. Thats why vaccine development, typically takes years or even decades. At best, to commercialize a licensed vaccine taking the normal path, were usually talking about a year-and-a-half to two years. That’s the figure that’s been quoted by the CDC and others.
But as Wistar’s Dr. David Wiener points out, that doesnt necessarily mean that we wont see a coronavirus vaccine being used much sooner, as we did in the case of Ebola. According to Wiener, once the Ebola vaccine in West Africa was tested through phase one, the researchers “did an exceptionally clever trial design,” which enabled them to use a relatively small number of people in a very quick phase two trial. Similarly, Weiner believes that high-risk populations could such as the elderly receive the vaccine much sooner and if needed, an “emergency use authorization” could be issued.
An emergency use authorization is where researchers get through early studies and show that a treatment is safe; then, they are given permission to start distributing it more widely. This approach is not usually used, but there has been a lot of discussion of emergency use of the COVID19 vaccine triggered by a group at Oxford University, which is going to start their vaccine trial sometime in the summer.
Importantly, even if Inovio’s vaccine candidate fails to reach commercialization, one or more of the several dozen other candidates now in the pipeline, are likely to do so. The Coalition for Epidemic Preparedness Innovations (or CEPI) mentioned earlier, is working with global health authorities and vaccine developers to support the development of a vaccine against COVID-19. To facilitate this effort, they are continuously maintaining their so-called “landscape database” of vaccine development programs identified from publicly available and proprietary sources.
As of April 8, 2020, the global COVID-19 vaccine R&D landscape database included 115 vaccine candidates, of which 78 were confirmed as active projects and 37 were still unconfirmed by CEPI. Of the 78 confirmed active projects, 73 were still at exploratory or preclinical stages, while the most advanced candidates had recently moved into clinical development. These clinical candidates include mRNA-1273 from Moderna, Ad5-nCoV from CanSino Biologicals, INO-4800 from Inovio, and LV-SMENP-DC as well as pathogen-specific aAPC from Shenzhen Geno-Immune Medical Institute. Numerous other vaccine developers had already indicated plans to initiate human testing in 2020.
.png)
In terms of resources, the U.S. government is stepping in to help. In early April, it announced collaborations with Johnson & Johnson and Moderna to simultaneously support clinical testing and the development of production infrastructure for COVID-19 vaccines. On March 30, Johnson & Johnson announced a joint investment with the U.S. government of $1 billion intended to create the capacity to manufacture more than 1 billion doses of a vaccine; the efforts will be funded in part by roughly $420 million from the U.S. Government. The funding will support non-clinical studies, according to the statement, as well as a Phase 1 clinical trial of Ad26 SARS-CoV-2, an investigational vaccine for COVID-19 developed by Janssen, a pharmaceutical subsidiary of Johnson & Johnson. According to the journal Science, this vaccine uses the same technology as Janssen’s investigational Ebola vaccine, which became available in the Democratic Republic of Congo in November 2019. The phase one clinical trial for this vaccine is set to begin no later than this coming fall and it could produce a vaccine available for emergency use in the U.S. in early 2021.
The agency has also committed to supporting Moderna in Phase 2 and 3 clinical trials of its COVID-19 vaccine, called SARS-CoV-2 mRNA-1273. The Phase 1 study for the vaccine, developed in partnership with the National Institute of Allergy and Infectious Diseases, got underway in early April.
On April 28, Pfizer Inc. said it could have a vaccine ready for emergency use by the fall. Pfizer CEO Albert Bourla told The Wall Street Journal that the company could be ready for a broader rollout involving millions of doses by the end of the year.
A U.S. government agency called BARDA intends to support five or six vaccine candidates, out of which two or three may ultimately be successful. Its goal is to work as quickly as possible to manufacture enough vaccine for the United States, as well as the rest of the world.
Given this trend, we offer the following forecasts for your consideration.
First, the United States and the UK will use “emergency use authorization” to get a viable vaccine to the public later this year.
This is consistent with the “right to try legislation” President Trump championed in his first year in office. And since both Trump and Boris Johnson recognize the importance of managing expectations, expect them to under-promise and over-deliver. Once Phase 1 trials establish an absence of toxicity or serious side-effects, barriers to deploying a vaccine that seems to be efficacious to all high-risk populations will be minimal. This will have an enormously powerful impact on economic activity and public opinion.
Second, rolling out billions of doses of the vaccine worldwide in 2021 will bolster America’s image and further undermine Chinese credibility.
In the coming era of Sino-American conflict, international perceptions will mean more than military might. By providing a solution to a global crisis created by China, the United States will regain any credibility with allies lost due to “America First” policies. Expect China to follow a similar course if they can develop and produce an effective vaccine on such a timetable. China will almost certainly employ industrial espionage in their attempt to beat the U. S. to a solution.
Third, what we’ve learned from the extraordinarily accelerated timeframe for a COVID19 vaccine will make future pandemics less disruptive.
The global vaccine R&D effort in response to the COVID-19 pandemic is unprecedented in terms of scale and speed. Given the imperative for speed, vaccines could be available to the general public under “emergency use protocols” by early 2021 and to high-risk populations much sooner. This represents a quantum leap from the traditional vaccine development pathway, which takes on average over 10 years; and it’s much faster than the accelerated 5-year timescale for the development of the first Ebola vaccine. Delivering on this forecast will necessitate the use of novel vaccine development paradigms involving parallel and adaptive development phases, innovative regulatory processes, and scalable manufacturing capacity. In order to assess vaccine efficacy, COVID19-specific animal models are being developed, including ACE2-transgenic mice, hamsters, ferrets, and non-human primates. And,
Fourth, like the flu vaccines, the COVID19 vaccine will be indispensable even if it’s not 100% effective against every new strain that mutates.
When all is said and done, emerging evidence will show that COVID19 is no more lethal than a normal influenza virus. However, it is much more contagious, meaning that without a vaccine more people will get it and so more people could die. Consequently, much of the panic will turn out to have been fueled by misinformation coupled with a lack of identified treatments or vaccines. We’ll see that outside of the New York area, the response was worse than the disease. Fortunately, the combination of viable treatments, isolation of high-risk populations, and the widespread availability of a relatively effective vaccine will enable us to put the panic behind us in 2020 and approach COVID19 like any other influenza virus of the past 50 years.
.png)
.png)

**
References
1. The Scientist. April 1, 2020. Amy Schleunes. US Selects Two COVID-19 Vaccine Candidates for Huge Investments.
2. The Scientist. April 1, 2020. Jef Akst. COVID-19 Vaccine Frontrunners.
https://www.the-scientist.com/news-opinion/covid-19-vaccine-frontrunners-67382
3. com. April 16, 2020. Nicolletta Lanese. When will a COVID-19 vaccine be ready?
https://www.livescience.com/coronavirus-covid-19-vaccine-timeline.html
4. Medical News Today. April 17, 2020. Ana Sandoiu. COVID-19: Vaccine may be ready by fall and other reasons for hope.
5. April 9, 2020. Tung Thanh Le, Zacharias Andreadakis, Arun Kumar, Raul Gomez Roman, Stig Tollefsen, Melanie Saville & Stephen Mayhew. The COVID-19 vaccine development landscape.
https://www.nature.com/articles/d41573-020-00073-5
6. com. April 22, 2020. Perry Chiaramonte & Angela Bertorelli. Possible coronavirus vaccine enters human testing trial.
https://www.foxnews.com/health/possible-coronavirus-vaccine-human-testing-trial
_아침독서상단(2).jpg)
.jpg)
.jpg)
.jpg)

